陈柱成实验室
Chen Zhucheng Laboratory
生物大分子机器复杂而精妙。我们利用晶体学、冷冻电子显微镜学等先进的结构生物学手段,结合生物化学、遗传学等方法,解析染色质调控分子机器的结构,洞察其工作机理,并将结构和机理与功能联系起来,希望推动疾病治疗药物和干预手段的开发。
组蛋白的甲基化、乙酰化、泛素化等化学修饰或直接改变染色质结构,或招募下游各种修饰阅读器,调控基因的表达,是一种经典的表观遗传机制。组蛋白修饰往往与其他染色质调控因子协调作用,从而靶向特定染色质,控制特定基因开关。尽管组蛋白修饰分子机器被广泛关注与研究,目前仍有许多重要问题没有解答。
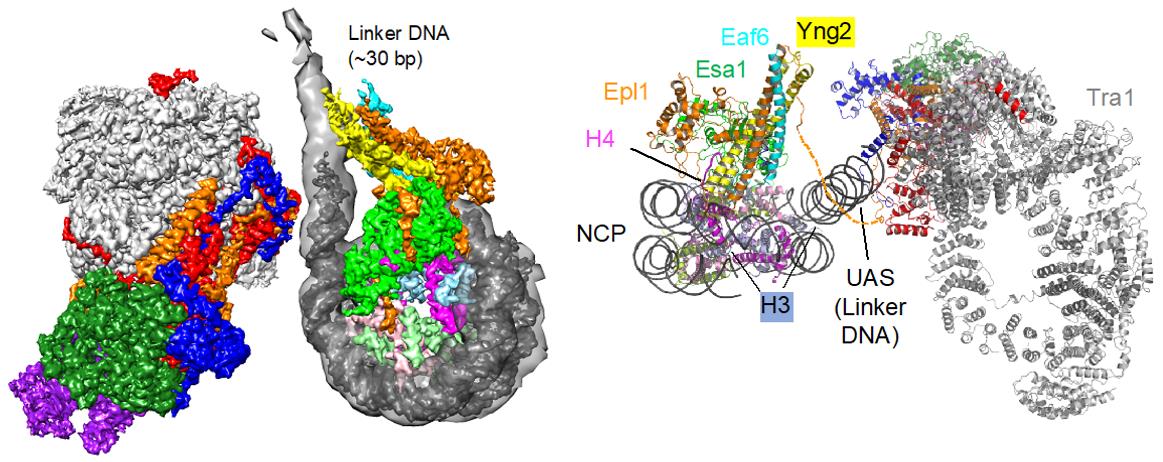
组蛋白H4的N末端与附近的核小体相互作用,在高级染色质结构和异染色质沉默中起特别重要的作用。酵母中的NuA4及其在哺乳动物细胞中的同源Tip60复合物是关键的组蛋白乙酰化转移酶 (HAT),它们选择性地作用于核小体H4,进而调节染色质包装,并在转录激活和DNA修复中发挥作用。尽管NuA4在调控染色质结构和基因表达方面具有根本的重要性,但不清楚它如何与核小体底物相互作用。
2016年,我们解析了NuA4核心催化模块的晶体结构,以及结合核小体的中等分辨率冷冻电镜结构。我们提出了一种新的基于核小体空间位置,而不是常见的基于氨基酸序列的组蛋白选择性乙酰化机制。2022年,我们解析了NuA4全酶结合核小体的高分辨率结构。我们的研究结果阐明了NuA4是如何组装,以及核小体识别和转录共激活的机制。该结构还提供了一个框架来帮助理解人类同源复合体Tip60。

扫一扫关注微信