Structure and regulation of human epithelial cell transforming 2 protein
Chen M#, Pan H#, Sun L#, Shi P#, Zhang Y, Li L, Huang Y, Chen J, Jiang P, Fang X, Wu C, Chen Z*. Structure and regulation of human epithelial cell transforming 2 protein. PNAS 117(2):1027-1035, 2020.
https://www.pnas.org/doi/epdf/10.1073/pnas.1913054117
新闻推送
https://mp.weixin.qq.com/s/eJw5EyLo9FK4TDNw76meow
上皮细胞转化因子2(Epithelial Cell Transforming 2, Ect2)是激活Rho 家族小G蛋白的鸟苷酸交换因子(GEF)。Ect2参与众多生物学过程,其中被研究得最广泛的是胞质分裂。胞质分裂是细胞分裂的最后一步。真菌和动物细胞在进行胞质分裂时,actomyosin收缩环的收缩作用,把细胞一分为二,使子细胞染色体数与母细胞保持一致,从而保证了遗传的稳定性。Actomyosin受上游RhoA信号的调控,而RhoA在胞质分裂时则主要被Ect2激活。然而,Ect2自身的活性如何被调控一直不清楚。
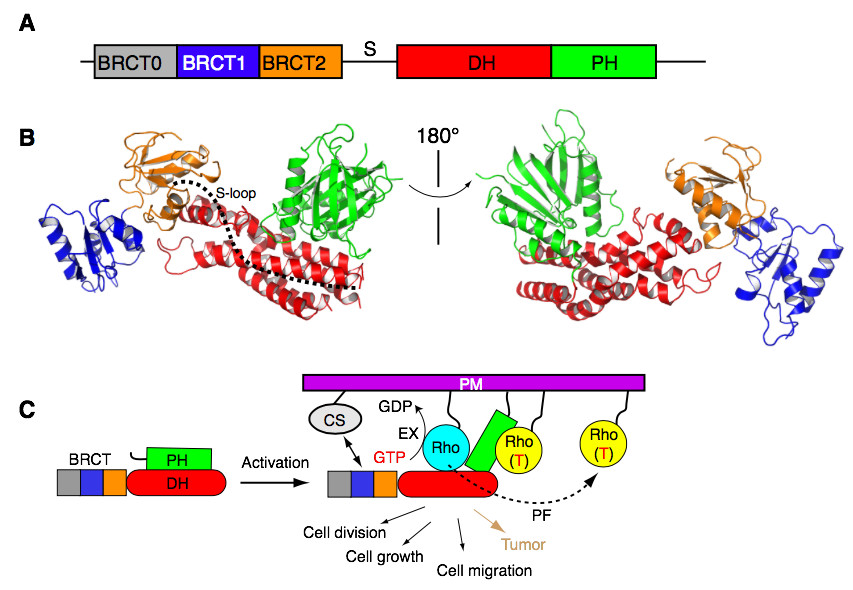
2019年12月30日,清华大学陈柱成实验室在PNAS杂志发表题为Structure and regulation of human epithelial cell transforming 2 protein 的文章,解析了Ect2的结构,阐明了Ect2的自抑制及激活的机理,并分析了与癌症相关的Ect2突变体的功能。研究人员通过对结构的解析,发现Ect2的自抑制由三个元件共同组成:N-端的BRCT结构域,C-端的PH(Pleckstrin Homology)结构域,以及中间连接处的S-loop。其中PH结构域直接与DH(Dbl Homology)结构域上的活性中心结合,阻止底物RhoA进入,在Ect2的自抑制中起核心作用。S-loop在DH结构域活性中心的外围,没有特定结构。通过测量与RhoA的结合常数,研究人员推断S-loop阻碍RhoA的结合,从而影响了Ect2的活性。BRCT结构域在DH结构域活性中心的远端,维持Ect2结构的稳定性,从而间接起到了自抑制的功能。该研究通过生物化学实验,发现Ect2会被GTP状态的RhoA激活,这提示了RhoA信号通路的正反馈调节作用。经过对Ect2蛋白表面的氨基酸进行突变筛选,研究人员发现了GTP状态RhoA结合在PH结构域,这暗示了RhoA对Ect2的变构激活作用。Ect2的这种双RhoA结合的模式(一个RhoA是底物,另一个RhoA是激活剂)并不常见。研究人员通过荧光共振能量转移(FRET)实验和氢-氘交换实验进一步确认了双RhoA结合的模式。细胞实验证明了Ect2的变构激活是胞质分裂所必需。因此,PH结构域不仅在Ect2的自抑制中起到了重要的作用,而且在Ect2的激活中也是不可或缺的。Ect2是一个原癌基因,在多种不同的癌基中出现突变和高表达。研究人员对癌症病人体内发现的突变体进行研究后,发现一些突变体使Ect2失去活性,另一些突变体使Ect2增加了活性。其中,R639Q/L突变体处于DP-PH自抑制作用界面,打开了Ect2自抑制的结构,增加了其GEF活性。将这个突变体过表达到细胞里时加快细胞增殖,促进细胞迁移,增强细胞的成瘤能力。在小鼠体内注射过表达这个突变体的细胞,细胞所形成的肿瘤比过表达野生型时的肿瘤体积会有明显的增长。上述结果说明了解除Ect2的自抑制会加强细胞的成瘤能力。有研究表明,敲低Ect2的表达抑制癌细胞生长,这提示Ect2是治疗癌症的潜在药物靶点。Ect2结构的解析,其实是其独特的DH-PH自抑制作用,为开发针对Ect2的药物铺平了道路。
Ect2的结构与调控模式图(A. Ect2结构域示意图。B. Ect2结构。C. Ect2自抑制和激活示意图。PM, plasma membrane; CS, centralspinlin complex; EX, GTP-GDP exchange; PF, positive feedback. )
清华大学陈梦冉博士、潘涵、孙凌飞博士以及北京大学医学部石鹏为本文的共同第一作者,清华大学陈柱成教授为本文的通讯作者。https://www.pnas.org/content/pnas/early/2019/12/27/1913054117.full.pdf